茶树己糖激酶基因CsHXK2的启动子克隆及表达特性分析
李娜娜, 刘莹, 张豪杰, 王璐, 郝心愿, 张伟富, 王玉春, 熊飞, 杨亚军, 王新超
作物学报
2020, 46 ( 10):
1628-1638.
DOI: 10.3724/SP.J.1006.2020.94166
植物己糖激酶是双功能蛋白, 具有磷酸化己糖和介导糖信号的关键性作用。前期研究中, 我们从茶树中克隆获得4个己糖激酶基因, 其中CsHXK2基因编码492个氨基酸残基, 与拟南芥AtHXK3、番茄LeHXK4归为Type A类HXKs。利用RT-PCR技术, 克隆获得长度为2029 bp的CsHXK2基因启动子。CsHXK2基因可能受到光照、低温、病原菌、糖和多种激素等信号的调控, 且可能特异性表达于叶、花、种子、根系、腋芽等组织。CsHXK2蛋白定位于叶绿体内。酵母突变体功能互补试验表明, 去除叶绿体转运信号肽的CsHXK2成熟蛋白具有葡萄糖和果糖磷酸化活性。茶树组织特异性表达分析显示, CsHXK2基因在根和茎中表达量最高, 而在老叶中表达量最低。CsHXK2基因的表达受低温胁迫而显著下调, 经炭疽菌侵染的茶树叶片内CsHXK2基因的表达也受到显著抑制, 而外源赤霉素(GA3)处理的茶树叶片内CsHXK2基因表达显著上调。本研究结果表明, CsHXK2基因在茶树的生长发育过程和逆境胁迫响应中发挥重要的调控作用。
View image in article
图5
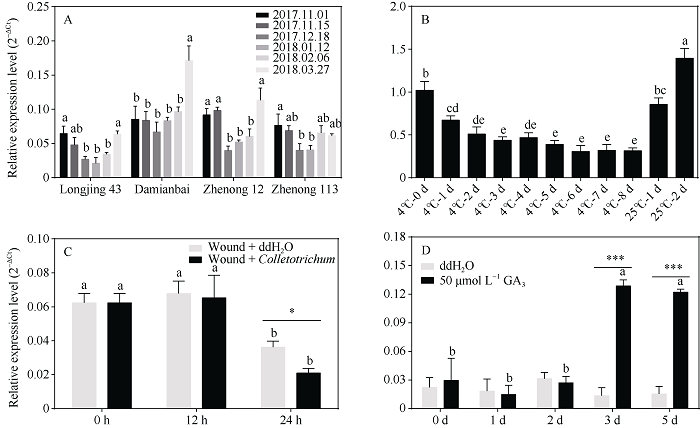
茶树CsHXK2基因在不同处理下的表达分析
A: 自然冷驯化; B: 4℃低温及25℃恢复; C: 炭疽菌接种; D: 50 μmol L-1外源GA3处理。柱上标以不同字母表示数据间的显著性差异(P < 0.05)。*表示0.05水平显著; ***表示0.001水平显著。
正文中引用本图/表的段落
对茶树品种‘龙井43’、‘大面白’、‘浙农12’和‘浙农113’自然冷驯化(越冬期)和脱驯化过程中的CsHXK2基因表达情况的分析发现, CsHXK2基因在4个不同茶树品种内具有相似的表达模式, 且在‘龙井43’、‘浙农12’和‘浙农113’内的表达随着环境气温的降低(2017.12.18, 2018.01.12)[26]而显著下调, 并随着气温的升高(2018-03-27)而显著上调(图5-A)。室内4℃低温处理能显著降低茶树叶片内CsHXK2基因的表达量, 且随着处理时间的延长而逐渐降低; 而CsHXK2基因的表达水平随着处理温度恢复至25℃而快速上升至处理前表达量(图5-B)。表明CsHXK2基因的表达受到低温的抑制。
采用有伤接种的方式, 对‘龙井43’叶片进行针头刺伤后分别喷施ddH2O和炭疽菌孢子悬浮液, 取样后检测CsHXK2基因的表达变化。由图5-C可知, 在刺伤喷洒ddH2O和炭疽菌的叶片中, CsHXK2基因的表达均随着处理时间延长至24 h而显著下调; 在24 h时间点, 炭疽菌处理叶片内的CsHXK2基因表达量显著低于对照。表明CsHXK2基因响应炭疽菌生物胁迫侵染而抑制表达。
对盆栽‘龙井43’叶片分别喷洒ddH2O和50 μmol L-1 GA3, 处理后取样并进行CsHXK2基因表达分析。喷洒ddH2O叶片内的CsHXK2基因表达无显著性变化; 而50 μmol L-1 GA3处理的叶片内, CsHXK2基因表达量在第3天和第5天显著上升, 且显著高于同一时间点的对照(图5-D)。说明CsHXK2基因参与响应赤霉素信号转导途径。
茶树原产于热带及亚热带地区, 性喜温暖, 冬季低温和春季倒春寒是威胁茶叶生产的主要气候因素。处于温暖湿润的茶树叶片极易感染由炭疽菌而引发的茶炭疽病, 造成茶叶品质及产量降低。自然冷驯化低温条件下, 茶树叶片内可溶性总糖、蔗糖、葡萄糖及果糖含量显著上升[30,31]。同样, 经炭疽菌侵染的植物叶片内总可溶性碳水化合物、蔗糖、己糖含量明显积累[32,33]。增加的可溶性糖, 包括葡萄糖和果糖, 既能参与细胞内碳和能量代谢, 又能作为信号分子而参与调控植物胁迫响应和生长发育[34]。本研究中, CsHXK2基因在低温及炭疽菌处理后叶片内的表达情况表明, 该基因响应低温及炭疽菌胁迫而表达显著下调(图5-A~C)。拟南芥AtHXK3基因响应低温、渗透和盐胁迫而在根系或嫩梢组织内表达降低[14]; 同样为type A类的麻风树JcHXK2基因, 在低温处理24 h的叶片内表达上调, 而在根系内表达下调[9]。因此, 感应低温和炭疽菌而表达抑制的CsHXK2基因是如何参与调节茶树适应外在刺激, 仍有待深入研究。
赤霉素(GA3)作为一种植物激素, 参与调控多种生长发育过程。赤霉素信号途径与糖信号之间存在着紧密关联, 其中HXKs是激素与糖联系的一个关键元件。离体矮牵牛花冠内, GA3对赤霉素诱导基因gip (gibberellin-induced gene)和查尔酮合成酶基因chs (chalcone synthase gene)表达的诱导受到葡萄糖的促进, 但这种葡萄糖引起的促进效果可以被HXK竞争性抑制剂甘露庚酮糖所完全摧毁, 表明HXKs参与的糖磷酸化相关信号转导与赤霉素信号相互作用, 进而诱导矮牵牛花冠发育过程中的基因表达和花青素积累[35]。阿洛糖作为葡萄糖的差向异构体, 能强烈抑制水稻赤霉素依赖性反应, 如第二叶鞘的伸长以及无胚半稻种子α-淀粉酶的诱导, 也能抑制具有赤霉素组成型响应表型的slr1水稻突变体的生长, 而这些抑制能被HXK抑制剂甘露庚酮糖所阻止, 表明阿洛糖通过HXK依赖途径抑制赤霉素信号传导[36]。本研究检测GA3处理的茶树叶片内CsHXK2基因的表达发现, 该基因转录本在处理样品中有显著的诱导富集(图5-D)。表明茶树赤霉素信号途径和CsHXK2基因表达关系密切, 可能与HXK介导的糖信号途径共同调控茶树的生长发育与逆境胁迫响应有关。
本文的其它图/表
-
 表1
引物信息
表1
引物信息
-
 图1
茶树CsHXK2基因启动子扩增及序列
图1
茶树CsHXK2基因启动子扩增及序列
A: CsHXK2启动子PCR扩增产物电泳图; B: CsHXK2启动子序列。
-
 表2
茶树CsHXK2基因启动子的主要顺式作用元件
表2
茶树CsHXK2基因启动子的主要顺式作用元件
-
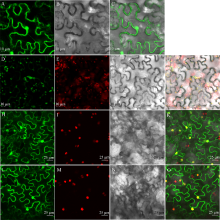 图2
茶树CsHXK2蛋白亚细胞定位
图2
茶树CsHXK2蛋白亚细胞定位
A~C和H~K: 35S::sGFP; D~G: 35S::CsHXK2::sGFP; L~O: 35S::CsHXK2-cTP::sGFP。A, D, H, L: GFP绿色荧光信号; E: 叶绿素自发荧光; I, M: 细胞核RFP红色荧光信号; B, F, J, N: 明场; C, G, K, O: 信号融合。
-
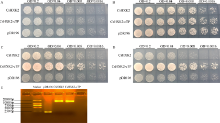 图3
CsHXK2蛋白酵母功能互补验证
图3
CsHXK2蛋白酵母功能互补验证
A: ddH2O; B: 2%半乳糖; C: 2%葡萄糖; D: 2%果糖; E: 酵母转化片段电泳检测。
-
 图4
茶树CsHXK2基因的组织特异性表达模式
图4
茶树CsHXK2基因的组织特异性表达模式
A: 春季‘龙井43’不同组织; B: 秋季‘龙井43’不同组织; C: ‘舒茶早’不同组织。柱上标以不同字母表示数据间的显著性差异(P < 0.05)。
|